См. также, что запасы золота в 2006 году составили 386,6 тонн (без учета золота в свопах). Доля золота в общем объеме российских валютных резервов составляла 3,8% в марте 2006 года. Россия занимает 14-е место в мире по количеству хранящегося золота.
Немного истории
Поскольку золото можно найти практически в любой точке мира, оно стало неотъемлемым элементом почти всех человеческих культур. Начиная с Древнего Египта, где были найдены предметы из декоративного золота, возраст которых превышает 5 000 лет.
В древние времена красота золота ассоциировалась с бессмертием и богатством богов, поэтому его использовали для изготовления ювелирных изделий и декоративных предметов. Это была также одна из первых монет, заменивших традиционный бартер.

Золотой браслет для детей. Египет. Около 2650 г. до н.э. Фото: www.metmuseum.org
Первые золотые монеты были отчеканены в 550 году до н.э. в Лидийском царстве, и с тех пор этот металл остается неотъемлемой частью денежной системы. Даже после введения современных бумажных денег, монеты оставались связанными золотым стандартом — системой, введенной в 1870-х годах, которая привязывает стоимость этих монет к определенному количеству золота.
Физические и химические свойства металла
Это один из немногих драгоценных металлов, встречающихся в природе в чистом виде. Чистое золото очень мягкое, всего 2,5-3 по шкале твердости Мооса. Это является преимуществом для простоты обработки: один грамм может быть свернут в тонкий лист толщиной всего 230 атомов и площадью один квадратный метр. Однако мягкость золота является недостатком для долговечности изделий из него, поэтому для его производства обычно используются сплавы с другими металлами (лигатуры).
Золото является хорошим проводником тепла и электричества и устойчиво к окислению и коррозии. Он имеет очень высокую температуру кипения и плавления.
Температура плавления солнечного металла составляет 1065 °C, а температура кипения — 2856 °C.
Как добывается золото

Северо-Восточная Сибирь, Куранахский горнорудный район. Фото.
Страны ЮАР, Австралия, США, Канада, Россия, Китай и Пакистан активно занимаются добычей полезных ископаемых. Одним из крупнейших золотых рудников является рудник Аврора в Гайане, Африка.
В древние времена золотые изделия просто находили в реке или на земле. Во время золотого бума добыча велась вручную, кирками и лопатами. К 1853 году гидравлическая добыча заменила независимых золотодобытчиков. Сегодня золото добывается в больших открытых или подземных шахтах.
Процесс начинается с того, что геологи берут пробы руды, чтобы определить лучшие места для добычи. Как только горные инженеры узнают, где находится золото и какие другие материалы его окружают, можно начинать процесс добычи.
Если металл находится близко к поверхности, его добывают в открытом карьере. По сути, в земле выкапывается огромная яма, вокруг которой, как по спирали, проходит дорога. Эта дорога используется для добычи и транспортировки руды.

Добыча руды через туннель
Более глубокое золото добывается подземным способом. Для этого прямо в скале прорываются большие туннели. Это гораздо более трудоемкий процесс, и в условиях ограниченного пространства приходится чаще использовать свою физическую силу. Взрывчатые вещества используются для того, чтобы сделать работу быстрее и эффективнее. Добытая порода транспортируется автомобильным и железнодорожным транспортом.
Характеристика физических свойств металла
Золото — один из самых тяжелых металлов, известных человечеству. Металл относится к группе 11 таблицы Д.И. Менделеева. Таблица Д.И. Менделеева. Сегодня известно 37 изотопов этого элемента, из которых только один, Au197, встречается в природе.
Золото как химический элемент известно с древних времен. Описание внешнего вида металла и его свойств интересовало многих ученых в разные периоды истории человечества. Золото — единственный металл, который изначально имел красивый желтый цвет. В чистом виде цвет драгоценного металла яркий и теплый, недаром он всегда ассоциировался с солнцем.
Плотность золота составляет 19,32 г/см3, в то время как только платина, осмий, рений и иридий имеют более высокую плотность. Представьте себе золотой куб с длиной грани в один метр — он будет весить 19,32 тонны. Такой же железный куб будет весить в три раза меньше — около 7 880 кг.
Золото плавится при температуре 1064,43 °C — при дальнейшем нагревании оно начинает испаряться и имеет температуру кипения 2947 °C. При плавлении цвет металла меняется с желтого на светло-зеленоватый.

Твердость золота составляет всего 2,5-3,0 по шкале твердости Мооса, а в чистом виде оно характеризуется мягкостью. Поэтому он редко используется в чистом виде и часто сплавляется с другими элементами, такими как серебро, медь или палладий, чтобы увеличить его твердость. Многие замечали при просмотре исторического видео или чтении книги, что герои часто пробуют золото глазами. Этот метод помог выявить подделки: Золотые монеты имели след на зубах, в то время как подделки не могли оставить такой след из-за других элементов в их составе.
На протяжении веков золото использовалось для изготовления различных изделий, таких как ювелирные украшения, посуда и статуэтки. Такое использование металла стало возможным благодаря двум его важнейшим свойствам: пластичности и ковкости.
Желтый металл — самый податливый из всех металлов. Он может быть расширен без нагрева в тонкие листы толщиной до 0,1 микрона. Даже в таком состоянии золото сохраняет свой цвет и важнейшие свойства. Примером такого использования металла является сусальное золото, которым покрывают купола церквей. Отличная ковкость и пластичность золота также может быть использована в промышленности: Самые тонкие провода для микрочипов могут быть сделаны из золота.

Физические свойства золота обеспечивают этому металлу широкий спектр применения в области микроэлектроники. Металл характеризуется низким сопротивлением, хорошей теплопроводностью и устойчивостью к окислительным процессам. Его способность отражать инфракрасное излучение используется в остеклении небоскребов, в стеклах кораблей, самолетов и вертолетов, а также в защитных шлемах космонавтов.
Благодаря своим физическим свойствам желтый металл подходит для различных видов обработки, включая полировку и сварку. Благодаря этим свойствам и хорошей сочетаемости с другими металлами, золото с древних времен занимает ведущее место как важнейший драгоценный металл и сырье для большинства ювелирных изделий.
Характеристика химических свойств металла
Химическое название желтого металла — Au, сокращение от «aurum», что в переводе с латинского означает «яркий рассвет». Золото классифицируется как инертное вещество. В нормальных условиях он не вступает в реакцию с природными веществами, за единственным исключением амальгамы — соединения золота и ртути.

Химические свойства золота исключают растворение металла в кислотах и щелочах. Это может произойти только в царской водке, которая представляет собой смесь азотной и соляной кислоты, причем обязательно в концентрированном виде. В работах алхимиков разных эпох эта реакция сопровождается образом льва, пожирающего солнечный диск.
Золото может быть растворено в жидком броме и в водном растворе цианида, но всегда в присутствии кислорода. Металл медленно растворяется в воде с хлором и бромом и в растворе йода в йодистом калии. При повышении температуры способность золота вступать в реакцию с другими соединениями увеличивается: Он может растворяться в селеновой кислоте. Кислота в этом случае должна быть горячей и иметь высокую концентрацию.

Одним из свойств золота является хрупкость его соединений, которые очень легко восстанавливаются до чистого металла. Ту же амальгаму достаточно нагреть до 800°C.
Практически ни одно вещество не может вступить в реакцию с золотом. Однако помните, что все ювелирные изделия, такие как ожерелья, серьги, браслеты и кольца, изготавливаются не из чистого золота, а из сплавов золота с другими металлами. Поэтому рекомендуется избегать контакта золота с веществами, содержащими ртуть, хлор и йод.
Химические свойства золота и его физические свойства как металла — не единственные свойства, активно используемые человеком. Золото обладает многими другими полезными свойствами и не зря активно используется в традиционной и народной медицине.
Золото в лечебных целях
Самые ранние методы работы с желтым металлом и его важнейшие физические и химические свойства можно найти в трудах древних ученых и алхимиков. Золото исследовали еще в Средние века, и оно остается предметом изучения и сегодня. Ученые всего мира пытаются найти новые способы использования этого драгоценного металла в медицине и промышленности.

В древние времена золото считалось лекарством от многих болезней, настоящим эликсиром жизни. В прошлом считалось, что золото способно излечивать болезни, боль, беспокойство, стресс и симптомы заболеваний.
Целебные свойства золота включают:
- Снятие воспалений;
- Улучшение протекания обменных процессов в организме;
- Излечение от аллергии;
- Благоприятное воздействие на нервную систему;
- Стимулирование мозговой активности и улучшение памяти;
- Повышение выносливости организма человека.
Исцеление золотом не требует никаких специальных мер, пока вы носите украшения из этого драгоценного металла. Древние врачеватели считали, что золото продлевает жизнь.

Основные целебные свойства золота широко используются в альтернативной медицине. Золотые украшения следует носить тем, кто имеет проблемы с сердцем или печенью, страдает от кожных заболеваний или имеет женские проблемы. Драгоценный металл способен убивать вирусы и вредные микроорганизмы, поэтому он может служить дополнительной профилактикой простудных заболеваний в сезон гриппа.
Полезные свойства солнечного металла позволяют народным целителям рекомендовать использование золота:
- Энергетической подпитки организма;
- Приобретения уверенности в собственных силах;
- Защиты от сглаза и порчи;
- Сохранения хорошего настроения и быстрого восстановления сил;
- Успешной борьбы с депрессиями и стрессами;
- Продуктивной работы мозга и памяти.
Использование золота в лечебных целях может подойти не всем: Некоторые люди индивидуально реагируют на металл.
Тем, кто хочет носить много украшений из желтого металла, следует проверить, не вреден ли он для организма. Свойства золота, которые должны помогать человеку, в некоторых случаях оказываются не столь полезными. При наличии чувствительности к металлу может нарушиться рост волос, возникнуть депрессия или просто плохое настроение, могут начать разрушаться зубы, произойти сбой в работе внутренних органов или просто возникнуть аллергия на коже. В таких случаях использование золотых украшений должно быть строго ограничено.
Золото

Золото, скорее всего, является первым металлом, с которым соприкоснулся человек (см. подробнее Первым ювелиром России, как считается, был Ерофей Марков, памятник которому находится в городе Екатеринбурге.
Об истории добычи золота см. Происхождение названия
Поскольку золото, вероятно, было известно до появления письменности, проследить историю его названия не представляется возможным. Однако известно, что слово золото имеет общий корень со словом «желтый» в славянских языках, а первоначальный вариант слова пишется zolto. Некоторые связывают происхождение слова «золото» со словом «солнце» (корень sol). Однако достаточно достоверных версий о происхождении названия нет.
Слово gold в европейских языках связано с греческим богом Солнца Физические свойства
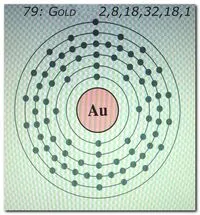
Схематическое изображение атома золота
Химический элемент периодической таблицы Менделеева, стр. № 79, в В. 196,967; он относится к благородным металлам. Известен только один стабильный изотоп Au197. Из искусственных радиоактивных изотопов наиболее важными являются Au195 и Au198. Конфигурация внешних электронов атома золота. : 5d10 6s1. Энергия ионизации Au — Au+ составляет 9,22 эВ.
Чистое золото — это мягкий металл чистого желтого цвета. Красноватый оттенок некоторых золотых изделий, например, монет, обусловлен примесью других металлов, особенно меди. Золото блестит в тонких слоях зеленого цвета. Золото обладает чрезвычайно высокой теплопроводностью и низким сопротивлением.
Золото — очень тяжёлый металл: Химические свойства
Золото относительно легко реагирует с кислородом и другими окислителями с помощью комплексообразователей. В водных растворах цианидов, например, золото растворяется в присутствии кислорода и образует соли циановой кислоты:
В реакциях с хлором путь реакции также значительно облегчается возможностью комплексообразования: если золото реагирует с сухим хлором в ~200 °С с образованием Физиологическое воздействие
Содержание золота в земной коре очень низкое — 3 мг/т, но месторождений и районов, сильно обогащенных этим металлом, очень много.
Для золота харатерна серебром, который обладает зеленоватым оттенком и относительно легко разрушается при переносе водой. В горных породах золото обычно рассеяно на атомарном уровне. В месторождения оно зачастую заключено в сульфиды и Получение

Промывка
Метод промывки основан на высокой плотности золота, благодаря которой в потоке воды, минералы с плотностью меньше золота (а это почти все минералы земной коры) смываются и металл концентрируется в тяжелой фракции, песка состоящего из минералов повышенной плотности, который называется Амальгамация
Метод амальгамации основан на способности ртути образовывать сплавы — Испании начиная с XVI века: это стало возможным благодаря наличию в Испании огромного ртутного месторождения — Цианирование
Золото растворимо в растворах синильной кислоты и ее солей, и это свойство привело к появлению различных методов добычи путем цианирования руд.
Метод цианирования основан на реакции золота с цианидами в присутствии атмосферного кислорода: измельченная золотоносная порода обрабатывается разбавленным (0,3-0,03%) раствором цианида натрия, а золото из полученного раствора цианида натрия NaAu(CN)2осаждается либо цинковым порошком, либо специальными ионообменными смолами.
Золотые сплавы в стоматологии
Благодаря высокой коррозионной стойкости и простоте обработки золото давно используется в качестве материала для зубных протезов. Для придания изделию высокой прочности используются специальные сплавы.
Традиционно чистота золота измеряется в британских Российская система проб
Принятая в России система отличается от общемировой. В России чистота золота измеряется См. также
Основные свойства золота

Благодаря своим химическим и физическим свойствам золото является одним из немногих драгоценных и редких металлов, встречающихся в природе. Этот драгоценный металл ценится за свою красоту и способность сохранять блеск и переливы в ювелирных изделиях и монетах. Он также используется в различных отраслях промышленности. На протяжении многих веков золото было предметом роскоши и никогда не теряло своей ценности, что подчеркивает высокую платежеспособность его владельца или страны, владеющей золотым запасом. Часто говорят, что золото — это международная платежная система, которая несет в себе вес и ценность каждой страны в мире.

Физические свойства
Этот минерал выглядит как маленькие кусочки металла неправильной круглой формы и соломенно-желтого цвета. Основные физические свойства золота:
- плавление металла происходит при температуре, равной 1063ºС;
- плотность вещества составляет 19,33 г/куб. см;
- показатели твердости, определяемые шкалой Мооса, могут быть от 2,5 до 3;
- довести металл до наивысшей точки кипения возможно при t=2948ºС;
- уровень удельной теплопроводности при t=0ºС равен 311,5 Вт/мК;
- прочность металла после отжига равна от 100 до 140 МПа.
Благодаря структуре кристаллической решетки золото является довольно мягким веществом, и для придания ему твердости в металл добавляют различные примеси, называемые лигатурами.
При добавлении других компонентов в виде сплавов общая температура плавления золотого сплава снижается, а физико-механические свойства самого металла изменяются.



Этот ценный природный минерал характеризуется и другими уникальными физическими свойствами.
- Высокий уровень пластичности. Из 1 грамма золота при желании можно вытянуть проволоку длиной до 2-2,6 метра или раскатать металл в виде плоского листа фольги толщиной в 1 микрон. Ввиду природной мягкости золота было замечено, что в течение 1 года монеты, бывшие в обращении, могли утрачивать до 0,1% своего изначального веса при отливке.
Пластичное свойство золота также позволяет использовать его в современных электронных системах.


- Высокая отражательная способность. Драгоценный сплав в готовом виде обладает способностью легко полироваться до яркого зеркального блеска. Тонкие листы раскатанного материала используют для нанесения позолоты. Это используется даже в космонавтике – тончайшие слои золота наносят на шлемы астронавтов и поверхности наружного космического оборудования, чтобы защитить их от пагубного воздействия излучений инфракрасного потока, который проявляет себя в условиях открытого космоса.


- Возможность распыления. Драгоценный минерал имеет свойство распадаться на мельчайшие фракции размером, равным длине световых волн. Такая способность позволяет этому материалу распыляться. Например, известно, что в водоемах и реках встречается дисперсия золота, которую невозможно увидеть визуально, но можно определить при помощи специальных приборов. Поверхность, покрытая тончайшим золотым слоем, способна пропускать лучи солнца, не нагреваясь при этом.
Эта способность используется для тонирования окон в южных широтах, где есть необходимость защиты помещений от перегрева.
Химические характеристики
Металл золото (аурум) называется Au, что буквально означает «солнечный свет» или «желтый». В системе Менделеева этот металл относится к группе 1 и имеет атомный номер 79. Химическая решетка Au имеет кубическую структуру.
Металл обладает особыми химическими свойствами.
- Относительная инертность. Золото не меняет своих свойств при контактах с серой и кислородом, не вступает во взаимодействие с азотом, углеродом, водородом и фосфором. Золото не реагирует на многие щелочи и кислоты.
- Валентность у этого химического элемента проявляет себя как +I или +III.
- При t=20ºС металл вступает в химическую реакцию с водными растворами хлора и брома. А водно-спиртовые растворы йода, вступая в реакцию с золотом 585 пробы, оставляют на нем участки темных пятен, чего не бывает, если капнуть йодом на золото 750 пробы.
- Цветовой спектр металла зависит от того, из частиц какого размера он состоит. Наиболее мелкие частицы золота могут иметь зеленовато-серые оттенки. По данным геологоразведки, на каждый 20 приисков приходится только один, где золото добывают в виде самородков желтого цвета.
Точная химическая формула золотого сплава зависит от дополнительных компонентов, которые входят в его состав в качестве лигандов.
СВОЙСТВА
Золотые слитки и самородки
Золото — очень тяжелый металл: плотность чистого золота составляет 19,32 г/см³ (шар из чистого золота диаметром 46,237 мм имеет массу 1 кг). Диамагнитный, что означает, что магнитное поле золота ослаблено. Среди металлов он занимает седьмое место по плотности после осмия, иридия, рения, платины, нептуния и плутония. Вольфрам имеет плотность, сравнимую с плотностью золота (19,25). Высокая плотность золота облегчает извлечение золота, поэтому даже простые процессы — такие как промывка с помощью промывочной машины — позволяют достичь высокой степени извлечения золота из промытой породы. Золото — очень мягкий металл: твердость по Моосу ~2,5, Бринелль 220-250 МПа (сравнимо с твердостью ногтя). Золото также чрезвычайно пластично: его можно ковать в листы, которые могут быть до ~Золото также чрезвычайно пластично: его можно отжигать в листах толщиной до 0,1 мкм (100 нм) (золотая фольга); при такой толщине золото прозрачно и желтеет в непрямом свете; в проходящем свете оно имеет голубовато-зеленый тон в дополнение к желтому. Золото может быть нанесено на проволоку с линейной плотностью до 2 мг/м. Температура плавления золота составляет 1064,18 °C (1337,33 K), температура кипения — 2856 °C (3129 K). Плотность жидкого золота ниже плотности твердого золота и составляет 17 г/см 3 при температуре плавления. Жидкое золото довольно летучее и испаряется задолго до температуры кипения.
ЗАПАСЫ И ДОБЫЧА
Содержание золота в земной коре очень низкое — 4,3-10-10 массовых процентов (0,5-5 мг/т), но существует множество месторождений и районов, активно обогащающихся этим металлом. Золото также встречается в воде. В одном литре морской и озерной воды содержится менее 5-10-9 граммов Au, что эквивалентно примерно 5 кг золота в 1 кубическом километре воды. Месторождения золота в основном встречаются в районах развития гранитоидов и в меньшей степени в ассоциации с базальными и ультраосновными породами. Наиболее важными физическими и химическими свойствами золота являются его встречаемость в природе в самородном виде и способность реагировать лишь с некоторыми веществами (ртуть, цианид). С развитием современных технологий химические методы становятся все более популярными. В 1947 году американские физики Ингрем, Хесс и Гайдн провели эксперимент по измерению фактического сечения поглощения нейтронов ядрами ртути. В качестве побочного эффекта эксперимента было получено около 35 мкг золота. Таким образом, была реализована вековая мечта алхимиков — превращение ртути в золото. Однако эта добыча золота не имеет экономической ценности, поскольку она во много раз дороже, чем добыча золота из самых бедных руд.
ПРОИСХОЖДЕНИЕ
Золотые изделия
Самородное золото — это основная форма золота, встречающаяся в природе. Он концентрируется в гидротермальных месторождениях и поэтому образует золотые руды, неравномерно распределенные в дробленых кварцевых жилах и сульфидах (пирит, арсенопирит, пирротин и др.). В сульфидных рудах самородное золото находится в тонкодисперсном состоянии. Во время окисления руд на поверхности мелкозернистое самородное золото частично растворяется и переоткладывается; в некоторых случаях оно обогащает верхние части рудных тел. Процессы их разрушения приводят к высвобождению частиц природного золота и накоплению их в уплощенных месторождениях; перемещаемые токами воды вместе с другими фракционными материалами, частицы округляются, деформируются, частично перекристаллизовываются; в результате электрохимической эрозии на них образуется тонкая оболочка из высокопробного золота, что приводит к общему увеличению содержания природного золота в уплощенных месторождениях.
Свойства золота
Физические свойства
Чистое золото — это мягкий, желтый металл. Красноватый цвет некоторых золотых предметов, например, монет, обусловлен примесями к другим металлам, особенно к меди. Золото также прозрачно в тонких слоях и становится полупрозрачным зеленым. Золото обладает чрезвычайно высокой теплопроводностью и низким электрическим сопротивлением. Золото — чрезвычайно тяжелый металл: шар из чистого золота диаметром 46 мм имеет массу 1 кг. Бутылка объемом 1 литр, наполненная золотым песком, весит около 16 кг.
Притяжение золота является преимуществом для его добычи. Более простые технологические процессы, такие как промывка в проволочных ящиках, могут обеспечить очень высокую степень извлечения золота из промытой породы.
Золото очень ковкое и пластичное. Из однограммового кусочка золота можно сделать трехкилометровую проволоку или изготовить золотую фольгу, которая в 500 раз тоньше человеческого волоса (0,0001 мм). Зеленоватый луч света проходит через такой кусок фольги. Мягкость чистого золота такова, что его можно поцарапать ногтем. По этой причине в ювелирных изделиях золото всегда сочетается с медью или серебром. Состав этих сплавов выражается клеймом, на котором указано количество частей по весу золота в 1 000 частей сплава (в российской практике). Анализ чистого золота соответствует 999,9, которое также называют «банковским золотом», поскольку из него изготавливают слитки.
Химические свойства
В нормальных условиях он не реагирует с большинством кислот и не образует оксидов, поэтому его причисляют к драгоценным металлам, в отличие от обычных металлов, которые легко изменяются под воздействием окружающей среды. Позднее было обнаружено, что водка может растворять золото, что разрушило предположение о его инертности.
Наиболее устойчивым состоянием окисления золота в соединениях является +3, в этом состоянии окисления оно легко образует устойчивые плоские квадратные комплексы AuX с однозарядными анионами (F -, Cl -. CN — ).4-. Соединения со степенью окисления +1, которые дают линейные комплексы AuX, также относительно стабильны.2— Долгое время считалось, что +3 — это максимально возможная степень окисления золота, но при использовании криптодифторидных соединений Au+5 (AuF5Соли AuF6— Соединения золота(V) стабильны только с фтором и являются сильнейшими окислителями.
Для веществ, чья степень окисления обычно равна +2, половина золота обычно окисляется до +1, а другая половина — до +3. Например, правильная ионная формула для сульфата золота(II) AuSO следующая4не будет Au 2+ (SO4) 2-, но Au 1+ Au 3+ (SO4) 2-2. Недавно были обнаружены комплексы, в которых золото имеет степень окисления +2.
Из чистых кислот золото растворимо только в горячей концентрированной селеновой кислоте:
Золото относительно легко реагирует с кислородом и другими окислителями с помощью комплексообразователей. В водных растворах цианидов, например, золото растворяется в присутствии кислорода и образует соли циановой кислоты:
В реакциях с хлором путь реакции также значительно облегчается возможностью комплексообразования: если золото реагирует с сухим хлором в ~200 °C с образованием хлорида золота(III), тогда как золото растворяется в концентрированном водном растворе соляной и азотной кислоты (aqua regia) уже при комнатной температуре с образованием иона хлорной кислоты:
Геохимия золота
Концентрация золота в земной коре очень низкая — 3 мкг/кг, но существует очень много месторождений и районов, которые активно обогащаются этим металлом. Золото также содержится в воде. В одном литре морской и речной воды содержится около 4*10-9 г золота.
Золото характеризуется своей природной формой. Другая форма — электрум, сплав золота и серебра, который имеет зеленоватый цвет и относительно легко разрушается при транспортировке с водой. В горных породах золото обычно рассеяно на атомарном уровне. В месторождениях он часто заключен в сульфиды и арсениды.
Различают месторождения первичного золота, карьеры, где оно откладывается в результате разрушения рудных залежей, и месторождения составных руд, где золото извлекается в качестве побочного продукта.
Добыча золота
Люди добывают золото с незапамятных времен. Уже в 5 тысячелетии до н.э., в эпоху неолита, человечество соприкоснулось с золотом в его естественном состоянии благодаря его распространению.
Археологи предполагают, что истоки золотодобычи лежат на Ближнем Востоке, откуда золотые украшения поставлялись в основном в Египет. В Египте первые золотые украшения III тысячелетия до н. э. были обнаружены в гробнице царицы Зер, одной из цариц Пу-Аби-Ура из шумерской цивилизации.
В России добыча золота традиционно началась 21 мая (1 июня) 1745 года, когда Герофей Марков, нашедший золото на Урале, объявил о своей находке в Канцелярии Верховного совета заводов в Екатеринбурге.
За всю историю человечества было добыто около 140 000 тонн золота.
В 2007 году было добыто 2 380 тонн золота, а в 2008 году — 2 330 тонн. Ведущими шахтерами были: Китай (275 тонн в 2007 году и 295 тонн в 2008 году); Южная Африка (275 тонн в 2007 году и 295 тонн в 2008 году); — Крупнейшими добывающими компаниями являются: Китай (275 тонн в 2007 году и 295 тонн в 2008 году), ЮАР (252/250), США (238/230), Австралия (246/225), Перу (170/175), Россия (157/165), Канада (101/100), Индонезия (118/90), Узбекистан (85/85), Гана (84/84), Папуа — Новая Гвинея (65/65), Чили (42/42), Мексика (39/41) и Бразилия (40/40).
В России насчитывается около 16 золотодобывающих компаний. Крупнейшим производителем золота в России является компания «Полюс Золото» с долей рынка около 20 %. Наибольшее количество золота добывается на Чукотке, в Красноярском крае и Амурской области. 3
Доказанные мировые запасы золота оцениваются в 100 000 тонн.
Строение атома и физические свойства
В таблице золото включено в шестой период подгруппы меди группы 11. Его название — Ау. Элемент имеет порядковый номер 79. Атом металла имеет 79 протонов и 117 нейтронов в ядре. На шести энергетических уровнях атома находится 79 электронов. Физический элемент существует в виде химически стабильного изотопа 197Au. Остальные нестабильны и возможны только в условиях ядерного реактора.
Распределение электронов по орбиталям электронной формулы золота имеет вид 1 s 2 s 2 s 2 s 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 f 14 5 s 2 5 p 6 5 d 10 6 s 1. В своих соединениях металл имеет валентность I. Это связано с наличием неспаренного электрона. Однако этот элемент также характеризуется валентностью II.
Золото относится к группе переходных металлов. В абсолютно чистом виде он имеет ярко-желтый цвет. Если в нем содержится медь, он может иметь красноватый оттенок. Химический элемент характеризуется кубической кристаллической решеткой с центральной гранью.
Основные физические свойства золота:
- температура плавления — 1064,18 °C;
- температура кипения — 2856 °C;
- атомная масса — 196,96655;
- плотность — 19,3 г/см 3 ;
- молярный объём — 10,2 см 3 /моль;
- твёрдость по шкале Мооса — 2,5.
Вещество характеризуется пластичностью и гибкостью. Золото — самый мягкий из всех металлов и прекрасно поддается обработке. Изделия из этого материала могут гнуться и повреждаться, поэтому их необходимо защищать от механических повреждений. При производстве столовых приборов производители добавляют к золоту дополнительные сплавы для повышения прочности изделий. Жидкое вещество является летучим и может испаряться до температуры плавления.
Минерал очень устойчив к химическим реакциям и процессам. Он является отличным проводником, быстро переносящим электричество и тепловую энергию. Металл легко полируется и приобретает мягкий блеск после обработки. Тонкая золотая пластина способна пропускать свет. Когда температура вещества понижается, его можно использовать для покраски окон.
Химические особенности
Золото имеет различные степени окисления: +1, +3, -1. +5 происходит с фтором, соединением, с которым оно является самым сильным окислителем.
Поскольку этот элемент характеризуется относительной инертностью, он, как правило, нерастворим в кислотах. Поэтому его можно освободить от примесей с помощью этих соединений. Однако есть и исключения: Золото можно растворить в селеновой и синильной кислотах, цианидах и акварегии.
В естественных условиях металл не окисляется под воздействием кислорода. Это одна из причин, по которой он считается ценным. При высоких температурах вещество взаимодействует с галогенами (йодом, бромом и хлором).
Наиболее стабильное состояние окисления — +3. Золото образует плоско-квадратные комплексы с односторонне заряженными анионами. Состояние окисления +1 считается относительно стабильным. Формально обычно выражается степень +2, но в веществах половина металла окисляется до +1, а другая половина до +3. В ауридах степень окисления Au равн а-1.
Золото может реагировать с перхлорной кислотой при комнатной температуре с образованием нестабильных хлороксидов; оно реагирует с кислородом и другими окислителями в комплексообразователях: при растворении в цианидах элемент образует цианоаураты.
Способы получения
Современные технологии позволяют получать драгоценный металл химическим путем. В 1947 году американским физикам удалось превратить ртуть в золото. Однако этот путь является дорогостоящим и поэтому экономически нецелесообразным.
Популярные способы получения вещества:
- Промывка. Поскольку металл обладает высокой плотностью, его можно получить в потоке воды, которая смывает примеси с материала. Предварительно добытые ископаемые дробят, а затем промывают. В результате остаётся шлих, который представляет собой золотой песок тяжёлой фракции. Промывка применяется ещё с древних времён для обработки небольших россыпных месторождений. Сегодня при этом методе используются специальные промывочные установки и драги. Во время промывки специалисты следят не только за мелкими, но и за крупными обломками, которые могут оказаться самородками.
- Амальгамация. Этот метод был распространён в Испании в XVI веке. Тогда дроблёную породу сначала увлажняли, затем смешивали со ртутью и дополнительно измельчали на мельницах. После этого получался сплав амальгам, который подвергали промывке для получения золота. Позже дроблёный материал стали пропускать через специальные шлюзы с медными листами, покрытыми тонким слоем ртути. Этот способ применяется только на месторождениях с большим объёмом драгоценного металла. Сегодня он популярен в Африке и Южной Америке.
- Цианирование. При этом методе золото смешивают с цианидами в присутствии кислорода. Полученный измельчённый материал обрабатывают раствором цианида натрия, а затем осаждают нужное вещество цинковой пылью или ионообменными смолами. Сначала такой способ использовался на крупных заводах в специальных чанах для дробления добытых ископаемых. Но с развитием технологий было придумано кучное выщелачивание: на водонепроницаемую площадку насыпают руду и орошают её растворами цианидов. Растворившееся вещество попадает в специальные колонны, в которых осаждается.
Существует метод регенерации. Для этого используется 10%-ная щелочь, которая воздействует на растворы солей золота, а затем осаждает металл в алюминий из горячего раствора гидроксида. Для получения элемента из сульфидных руд используются многоступенчатые процессы с высокой степенью очистки.

















